
L’évaporation et la condensation mettent en jeu des quantités importantes d’énergie. L’évaporation absorbe de l’énergie alors que la condensation en libère.
L’évaporation
Le matériel
- 1 ventilateur
- 1 brumisateur
- 1 thermomètre
- de l’eau tiède ou chaude
L’expérience
On place un ventilateur à une cinquantaine de centimètres d’un thermomètre. On remplit un brumisateur (lave-vitre…) d’eau tiède ou chaude. Si on vaporise cette eau dans le courant d’air du ventilateur, la température indiquée par le thermomètre baisse. Ainsi, bien que l’eau vaporisée soit chaude, l’énergie thermique absorbée lors de l’évaporation est suffisamment importante pour abaisser la température.
Une gouttelette d’eau en suspension dans l’air s’évapore, elle prend l’énergie à l’air qui l’entoure. Ce phénomène est également présent dans la nature. Les gouttes de pluies qui tombent d’un nuage peuvent, durant leur chute, traversée de l’air plus sec, s’évaporer et refroidir l’air ambiant.

Énergie absorbée lors de l’évaporation. © IPSL-Julie Sistenich, d’après Jean-Louis Dufresne, LMD-IPSL
Pour évaporer un gramme d’eau, il faut fournir environ 6 fois plus d’énergie que pour chauffer ce gramme d’eau de 0°C à 100°C. L’importance de l’énergie thermique absorbée lors de l’évaporation est perceptible lors d’expériences banales. Lorsque l’on est mouillé, la sensation de froid est plus forte que lorsque l’on est sec à cause de l’évaporation de l’eau sur la peau. L’eau contenue dans une gourde poreuse (faite en cuir, en tissus…) est rafraîchie grâce à l’évaporation de l’eau qui humidifie les parois…
La condensation
Le matériel
- 1 chauffe-plat
- 2 plats identiques, en verre avec leur couvercle (les couvercles doivent pouvoir se soulever ou rester très légèrement ouverts)
- de l’eau
- 1 thermomètre
L’expérience
Sur un chauffe-plat on dispose deux plats identiques, en verre et avec leur couvercle. (Attention : pour éviter que la dilatation des gaz ne fasse exploser les récipients, les couvercles doivent pouvoir se soulever ou rester très légèrement ouvert). Dans l’un des récipients, le fond est recouvert d’eau. Après quelques minutes des gouttes d’eau se forment sur le couvercle. La température du fond des deux plats est identique car ils sont posés sur le même chauffe plat, qu’en est-il de la température des couvercles ?
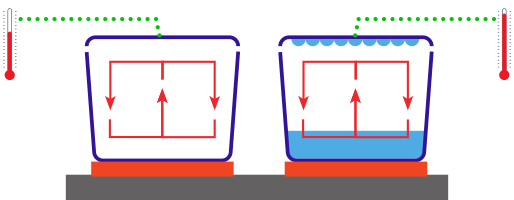
Énergie libérée lors de la condensation. © IPSL-Julie Sistenich, d’après Jean-Louis Dufresne, LMD-IPSL
Une mesure avec un thermomètre ou un simple toucher permet de constater que la température du couvercle est plus élevée pour le récipient contenant de l’eau que pour l’autre. Dans les deux cas, la convection transporte de l’énergie thermique du fond vers le couvercle. Mais dans le récipient contenant de l’eau il y a également transport de vapeur d’eau qui s’évapore au fond et se condense sur le couvercle. Cette condensation apporte un supplément d’énergie thermique au couvercle qui se traduit par une température plus élevée.
Pour aller plus loin
- Mise en évidence de la chaleur latente liée à l’évaporation et à la condensation de l’eau : Applications au fonctionnement des orages. Camille Risi, Venance Journé, Jean-Louis Dufresne, Jean-Yves Grandpeix, Aymeric Spiga, La Météorologie, volume 94, p. 15, 2016.
- « La Physique du climat », Jean-Louis Dufresne, in « Graines de Sciences 2 », pp.77-100, Éditions Le Pommier, Paris, 2000.
- Le rapport de stage de Richard Denis et son annexe, plus détaillée.




